들어가며
지구상의 모든 생명체는 유전inheritance을 통해서 자신이 가진 개체의 정보를 다음 세대로 전달하며, 유전 정보를 가지고 있는 물질을 유전자gene라고 한다. 1944년 Oswald T. Avery는 DNA가 유전자라는 것을 밝혔으며, 이후 Rosalind Franklin이 찍은 DNA x선 회절 데이터를 바탕으로 1953년 James Watson과 Francis Crick이 DNA가 아데닌(A), 구아닌(G), 사이토신(C), 싸이민(T) 네 개의 염기들로 구성되어 있으며, A와 T, G와 C가 수소겹합(A-T: 이중 수소결합, G-C: 삼중 수소결합)을 통해서 상보적complementary으로 염기쌍base pair를 형성하는 이중나선 구조를 가진다고 밝혔다. 나아가 James Watson과 Francis Crick은 DNA 염기서열에 담겨 있는 유전정보가 염기쌍의 상보성을 바탕으로 복제됨으로써 다음 세대로 전달된다고 제안하였으며, 이 제안은 1958년 Arthur Kornberg가 대장균에서 DNA를 합성하는 DNA 중합효소DNA polymerase를 발견함으로써 증명되었다.
유전 정보를 가진 DNA는 우리가 일상생활을 하는 도중에 다양한 요인들 − 태양에서 나오는 자외선, 담배 연기, 공해뿐만 아니라 세포 자체의 대사 과정에서 발생하는 산화물이나 알칼리성 화합물에 의해서 손상을 입는다. DNA는 이렇게 매일 손상을 입지만 우리가 별문제 없이 정상적으로 생활할 수 있는 이유는 DNA의 손상을 원상복귀시켜주는 다양한 기전mechanism들이 우리 몸속(세포)에 존재하기 때문이다. DNA 손상복구 기전들은 박테리아에서 사람까지 진화적으로 보존되어 있다. 만약, DNA 손상복구 메커니즘이 정상적으로 작용하지 않을 경우, DNA의 손상은 유전 정보를 변화시켜 돌연변이를 유도하고, 그 정도가 지나치면 암과 같은 심각한 질병을 유발하여 생존을 위협하거나 변화된 돌연변이가 다음 세대로 이어져 유전병에 걸리게 된다. 따라서 DNA의 손상복구는 개체의 정상적인 생명 활동에 중요하다. DNA 손상복구 메커니즘을 밝힌 Tomas Lindahl, Aziz Sancar, Paul Modrich 세 명이 2015년 노벨 화학상을 받았다.
DNA가 입는 손상의 종류는 상당히 많으며, 각 손상의 종류별로 복구하는 기전이 다르다. 이 글에서는 여러 DNA 손상복구 기전들 중에서 대부분의 손상을 복구할 수 있는 가장 잘 알려진 5가지의 손상 복구 기전을 소개하고자 한다.
1.DNA 미스매치mismatch와 미스매치 복구
DNA는 염기들의 상보적인 수소결합(A-T/G-C)을 기반으로 복제replication를 통해서 유전 정보를 다음 세대로 전달한다. 정확한 유전정보의 전달을 위해서는 DNA 복제가 정확하게 이루어져야 한다. DNA의 복제는 DNA 중합효소DNA polymerase에 의해서 이루어지는데, 보통 DNA 중합효소는 DNA를 합성하는 동안 105 중 한 번 정도 상보적이지 않은 염기들끼리 쌍을 이루는 실수를 한다. 예를 들어, G는 C와 쌍을 이루어야 하는데, G가 C 대신 T와 쌍을 이루게 되는 경우가 발생하고, 이렇게 상보적이지 않은 염기쌍을 ‘DNA 미스매치mismatch’라고 한다. 사람이 가진 전체 염기쌍의 개수가 대략 3*109 이기 때문에, DNA 중합효소에 의해서 대략 30,000 개의 DNA 미스매치가 발생할 수 있다. 하지만 DNA 중합효소는 자체적으로 DNA 미스매치를 인식해서 합성된 DNA를 제거하고 새롭게 합성하는 능력을 갖추고 있다. 이는 마치 스마트폰에서 텍스트를 쓰다가 오타를 내면 백스페이스를 이용해서 오타를 지우고 다시 쓰는 것과 동일하다. 이 기능을 거치고 나면 DNA 중합효소는 107 중 한 번 정도의 DNA 미스매치를 만드는데, 여전히 300 개의 DNA 미스매치가 형성될 수 있다. 3*109 중에 300 개가 별거 아니라고 생각할 수 있으나, 중요한 유전자에 발생했을 때 돌연변이를 일으키며, 세포가 분열에 의해 DNA가 복제될 때마다 이 정도의 오류가 발생한다고 생각하면 결코 무시할 수 없다. 나아가 이러한 DNA 미스매치들은 그 다음 번 복제에서 완전히 다른 염기쌍으로 바뀌게 된다. 즉, G-T 미스매치의 경우, T는 다음 복제에서 A와 염기쌍을 이루어 G까지 A로 바뀌고 이는 영구적인 돌연변이가 된다. 따라서 ‘DNA 미스매치 복구’는 다음번 복제 이전, 실제로는 DNA 복제가 진행되는 도중에 진행된다.
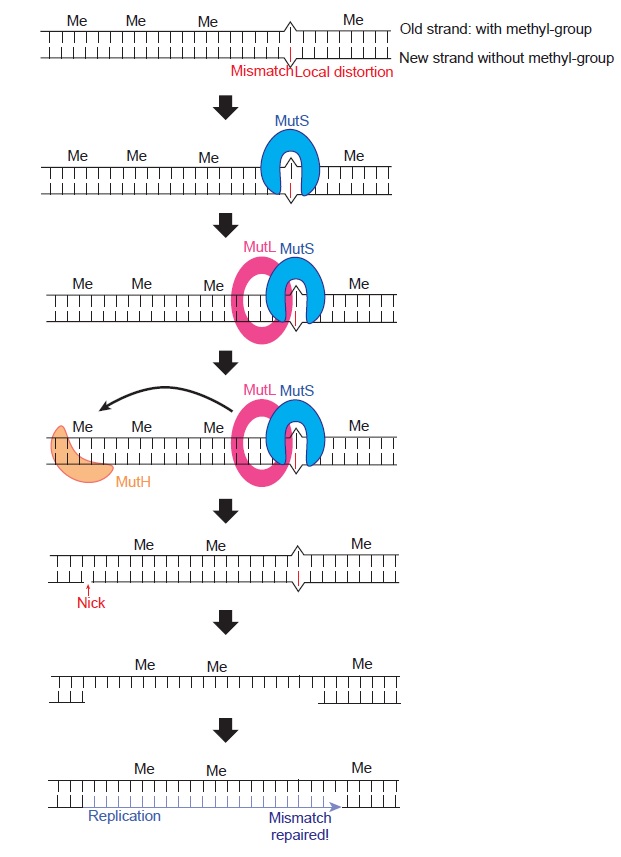
DNA 미스매치 복구 메커니즘은 대장균E coli에서 잘 정립되어 있다[그림 1]. DNA 미스매치가 발생하면, 그 부분의 이중나선은 국소적으로 왜곡distortion된다. 이러한 왜곡을 MutS라는 단백질이 인식한다. MutS는 MutL이라는 단백질과 결합한 후에 MutH라는 단백질을 활성화시켜 미스매치가 형성된 DNA 가닥의 한 부분을 즉 ‘nick’을 끊는데 nick에서부터 미스매치가 포함된 DNA 가닥이 제거되고, 그 제거된 부분을 DNA 중합효소가 새롭게 합성함으로써 미스매치가 없는 DNA로 복구된다. DNA는 이중나선, 즉 두 가닥으로 이루어져 있기 때문에, DNA 미스매치 복구 과정에서 어떤 가닥이 미스매치를 포함한 가닥인가를 구별하는 것이 중요하다. 미스매치는 DNA를 복제할 때 새로 합성되는 DNA 가닥에 형성되기 때문에, 새로 합성된 가닥이 아닌 원래 가닥을 제거하면 돌연변이가 발생한다. 원래 가닥과 복제된 가닥의 구별은 염기에 결합한 메틸기methyl-group에 의해서 이루어진다. 복제되기 전의 DNA 염기들 중 일부분은 메틸기가 결합되어 있으나, 갓 복제된 DNA 가닥은 메틸기가 전혀 없기 때문에 메틸기가 없는 DNA 가닥이 새로 형성된 가닥이고, 이를 통해서 미스매치가 형성된 가닥을 구별한다. 사람의 경우에도 대장균과 거의 유사한 방식으로 DNA 미스매치가 복구되고, 이러한 DNA 미스매치 복구 시스템에 문제가 발생하면 대장암, 방광암, 및 자궁내막암 등에 걸릴 수 있다.
2.알킬화 염기alkylated base와 염기 절개 복구base excision repair
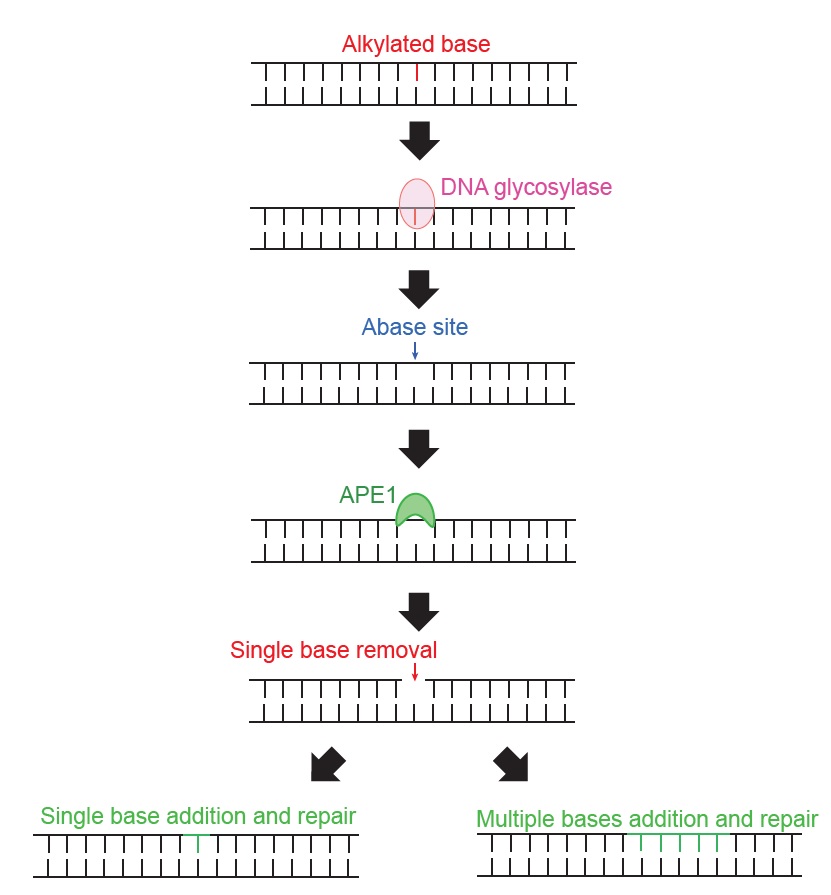
세포 대사 과정 중에 다양한 활성 산소 및 질소 화합물들이 발생하고, 이들은 반응성이 높아서 DNA의 염기들을 알킬화alkylation한다. 비록 염기의 알킬화가 DNA 구조에 큰 변화를 유발하지 않지만, 알킬화된 염기들은 비정상적인 염기쌍을 형성할 수도 있으며 화학적 변화를 거쳐 다른 염기로 바뀌게 된다. 예를 들어, G에 산소가 결합된 oxo-G의 경우는 C 뿐만 아니라 A와도 염기쌍을 형성할 수 있다. 또한, 알킬화된 C에서 아민기(NH2-)가 떨어지면 T로 바뀌게 된다. 따라서 이러한 알킬화 염기들을 제거하는 것 또한 유전정보를 보존하는 데 중요하다. 알킬화된 염기들을 복구하는 기전이 ‘염기 절개 복구(이하 BER)’이다[그림 2]. BER은 ‘글라이코실레이즈glycosylase’라는 단백질에 의해서 시작된다. 글라이코실레이즈는 알킬화된 염기를 인식한 후, DNA 이중나선을 끊지 않고, 염기만을 제거한다. 이렇게 염기가 사라진 부분을 ‘탈염기abasic’라고 부른다. 탈염기 부분이 생기면 APE1라는 단백질이 탈염기를 인식해서 그 부분에서 DNA 가닥을 끊는다. 결국, DNA에서 염기 하나가 빠지게 되는데, 이 빠진 부분을 DNA 중합효소가 합성하여 알킬화된 염기를 원상 복구한다. 혹은 염기 하나가 빠진 부분에 하나만 합성하지 않고 DNA 중합효소가 여러 염기쌍을 새로 합성하여 복구할 수 있다. BER이 정상적으로 작용하지 않으면 신경질환 및 암이 발생할 수 있다.
3.싸이민 이분자체thymine dimer 및 화합물 결합 염기와 뉴크레오타이드 절개 복구nucleotide excision repair, NER
우리는 거의 매일 햇빛에 포함된 자외선에 노출된다. 자외선은 에너지가 높아서 세포 내에 있는 DNA의 염기들의 변성을 유도한다. 특히, 이웃하는 두 개의 싸이민(T)들이 자외선에 노출되면 싸이민들끼리 공유결합을 형성하여 이분자체dimer를 형성한다. 이러한 싸이민 이분자체는 이웃한 염기들이 공유결합한 상태라서, 각 염기를 하나씩 넣으면서 합성하는 DNA의 복제 혹은 전사transcription가 싸이민 이분자체를 만나면 정상적으로 진행되지 못한다. 한편, 다양한 화합물들이 DNA 염기와 결합하여 염기를 변형시킬 수 있다. 예를 들어, 바베큐를 할 때 나오는 연기 속에 benzo-a-pyrine이라는 물질이 섞여 있는데 이 물질은 DNA 염기와 결합하여 암을 일으킨다. 이러한 싸이민 이분자체의 공유겹합을 풀어주고 화합물이 결합한 DNA 염기에서 화합물을 제거하는복구 기전이 바로 ‘뉴클레오타이드 절개 복구(이하 NER)’이다. NER이 정상적으로 작동하지 않으면 자외선에 의한 DNA 손상을 복구하지 못하기 때문에, 햇빛을 받으면 피부가 심각하게 손상되는 색소성건피증xeroderma pigmentosum을 앓게 되어, 낮에 활동을 할 수 없게 되고 심각한 경우는 뇌 질환 및 발달 장애를 겪을 수 있다.
싸이민 이분자체 혹은 화합물이 결합된 염기들은 DNA 이중나선에 상당한 왜곡을 유발한다[그림 3]. 이러한 왜곡을 XPC라는 단백질이 인지하는데, 변성된 염기가 포함된 DNA 가닥이 아닌 그 반대편 가닥에 강하게 결합한다. 즉, 변성된 염기나 화합물 자체를 인식하는 것이 아니라 이에 의한 DNA의 왜곡을 인식하고, 반대 가닥에 결합하기 때문에 다양한 염기의 종류와 무관하게 변성을 인식할 수 있다. 즉, NER은 가장 다양한 염기의 변성을 복구할 수 있는 손상복구 기전이다. XPC에 의한 손상 부위 인식 후에, TFIIH라는 단백질이 손상 부위에 결합된다. TFIIH는 XPC에 의해서 인식된 DNA의 왜곡이 싸이민 이분자체 혹은 변성된 염기에 의한 것인지를 한 번 더 확인하고, DNA 손상이 맞을 경우, XPA 및 RPA와 결합하여 손상 부위 주위에 DNA 이중나선을 푼다. 그리고 DNA 단일 가닥을 끊어주는 XPF 및 XPG라는 단백질들이 손상된 염기 주위에 결합하여 nick을 만들어 손상된 DNA 가닥을 도려낸다. 이후 비워진 단일 나선 부분DNA gap을 DNA 중합효소가 합성하여 정상적인 이중나선으로 만든다. 이 과정과 비슷하지만, 변성된 염기를 XPC가 아닌 RNA 중합효소RNA polymerase가 인지할 수 있다. RNA 중합효소에 의해서 DNA로부터 메신저 RNAmRNA로 전사가 진행되는 동안, 변성된 염기는 RNA 중합효소가 합성하는 것을 방해하여 멈추게 한다. 이렇게 멈춰진 RNA 중합효소를 CSA/CSB라는 단백질들에 의해 DNA로부터 제거되고, CSA/CSB는 손상된 염기를 TFIIH에 전달한다. 그리고 그 이후 과정은 위에서 언급한 것과 동일하게 이루어진다.
4.DNA 이중나선 절단과 상동재조합homologous recombination 및 비상동 끝점 결합non-homologous end joining
DNA 이중나선 절단은 위에서 언급한 DNA 손상과 다르게, DNA 이중나선의 두 가닥이 모두 끊어지는 것으로, 각 가닥에 형성된 nick이 가까우면 발생한다[그림4]. DNA 이중나선 절단은 DNA가 방사능에 노출되거나 활성산소와의 반응 등에 의해서 발생한다. 앞에서 언급한 DNA 손상복구 과정들은 모두 DNA 이중나선 중 한 가닥만 손상을 입은 경우라서 손상을 입지 않은 반대편 가닥의 염기서열과 상보성을 이용하여 손상된 가닥을 복구할 수 있다. 반면, DNA 이중나선 절단은 염기의 상보성을 이용한 복구가 불가능하며, 이중나선 절단이 발생한 부분에서 DNA 복제와 전사가 멈추게 된다. 따라서 DNA 이중나선 절단은 가장 심각한 DNA 손상이다. 이러한 DNA 이중나선 절단을 복구하는 기전은 크게 두 가지가 있다. 하나는 ‘상동재조합Homologous Recombination, (이하 HR)’이고 다른 하나는 ‘비상동 끝점 결합Non-Homologous End Joining, (이하 NHEJ)’이다.
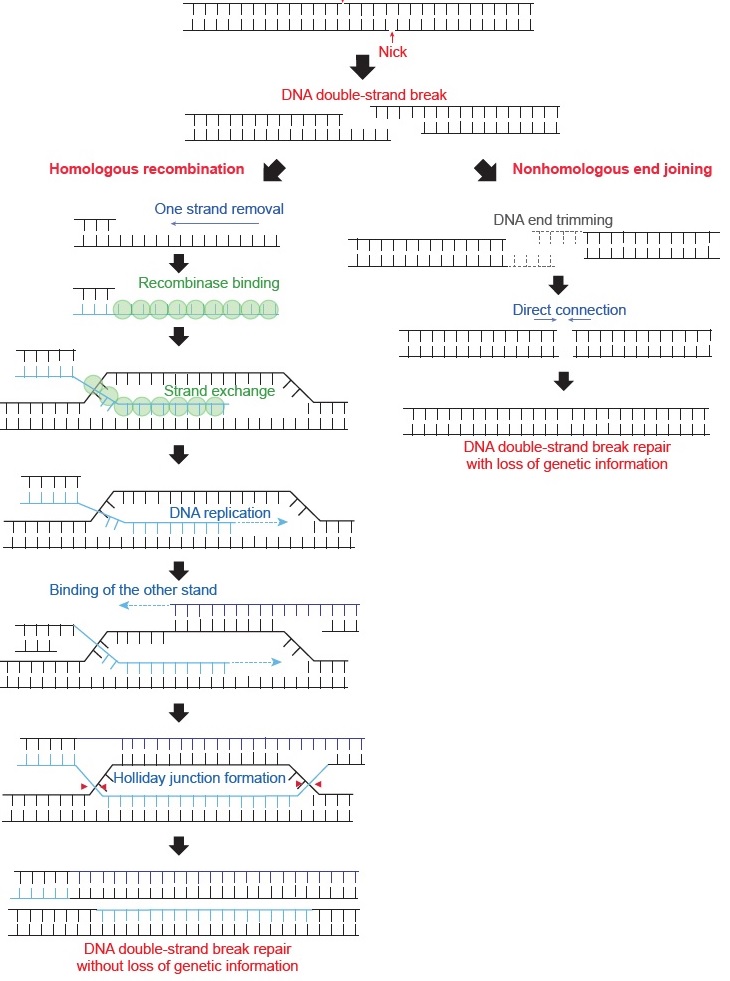
‘HR’은 DNA 이중나선 절단을 유전정보의 손실 없이 복구하는 메커니즘이다. 끊어진 DNA 자체의 상보성을 이용하여 복구가 불가능하기 때문에, HR은 복제된 DNA 혹은 상동염색체의 유전정보를 이용하여 복구한다. 따라서 HR은 DNA가 복제되는 동안이나 세포분열(특히 생식세포 분열) 동안에서 이루어진다. DNA 이중나선이 끊어지면, 절단 부위에서부터 이중나선의 한 가닥이 제거되어 긴 단일 나선을 형성하게 되고, 이 단일나선에 재조합 단백질들recombinase이 필라멘트 형태로 결합한다[그림 4]. 이렇게 형성된 필라멘트는 복제된 DNA 혹은 상동염색체에서 상보적인 염기서열을 검색하여 찾는다. 상보적인 염기서열을 찾으면, 복제된 DNA 혹은 상동염색체 DNA에 침투하여 새로운 염기쌍을 이룬다(Strand exchange). 그리고 단일나선 부분의 끝부터 DNA 중합효소가 합성을 시작한다. 끊어진 반대편 가닥은 strand exchange 이후에 생기는 단일나선 부분에 결합하여 합성을 시작하고, 결국 4개의 DNA 가닥이 서로 섞이는 아주 특별한 DNA 구조가 형성되는데 이를 ‘Holliday Junction’이라고 부른다[그림 4]. Holliday Junction은 이 특별한 DNA 구조를 인식하여 이를 깔끔하게 끊고 다시 결합시키는 단백질들에 의해서 풀리고, 이를 통해 이중나선 절단이 유전정보의 손실 없이 복구된다. 이러한 상동재조합은 생식세포 분열 과정에서 반드시 일어나는데, 이를 통해서 엄마와 아빠의 유전자가 자식의 유전자에서 서로 섞이게 된다. HR이 정상적으로 일어나지 않으면 유방암이 발생할 수 있으며, 생식세포 분열 동안 염색체가 정상적으로 분리되지 않을 수 있다.
반면, DNA가 복제되고 있지 않거나 세포분열기가 아닌 경우는 DNA 이중나선 절단이 HR을 통해서 복구될 수 없다. 하지만 DNA 이중나선 절단은 그 자체로 엄청나게 심각한 문제임으로 세포는 이를 빠르게 복구하기 위해서 절단된 부분을 바로 결합하는데, 이 과정이 ‘NHEJ’이다. 하지만 잘린 이중나선은 일반적으로 단일나선 가닥들이 나와 있는 형태이기 때문에, 이러한 단일나선 가닥들을 우선 갈무리한 후에, 끊어진 부분을 ligase라는 단백질이 연결한다. 이 과정을 통해서 DNA 이중나선 절단은 간단하고 빠르게 복구되지만 염기서열의 일부가 제거되어 유전정보의 손실이 발생할 수 있기 때문에, NHEJ는 HR과 다르게 유전정보를 완전하게 보전하지 못한다. 반대로 생각하면 유전 정보의 일부 손실을 감수하고서도 DNA 이중나선의 끊어짐을 복구하는 것이 생물학적으로 더 중요하다고 말할 수 있다.
5.Interstrand crosslinkingICL 과 판코니빈혈Fanconi anemia 복구 과정
앞에서 말한 바와 같이 DNA는 염기쌍들의 수소결합을 통해 이중나선을 형성하고 있다. 때때로 염기쌍들이 화합물을 매개로 수소결합 대신 공유결합을 형성하게 되는데 이를 ‘Interstrand crosslinkingICL’라고 부른다. ICL이 발생하면 DNA 두 가닥이 공유결합으로 연결되어 분리될 수 없기 때문에 복제 혹은 전사가 정상적으로 일어나지 못한다. 이는 판코니 빈혈Fanconi anemia을 유발하는데 이 판코니 빈혈은 재생불량성 빈혈로 혈액암을 유발할 수 있다. 그리고 이러한 ICL은 보통 판코니 단백질들에 의해서 복구가 된다. 보통 복제 분기점이 ICL에서 멈춤으로써, ICL을 인식하고, 판코니 단백질들을 포함한 여러 단백질들이 ICL 주변의 DNA 가닥을 자른다[그림 5]. 이때, 잘린 부분들은([그림 5]의 top DNA) DNA 이중나선 절단과 같은 형태가 되어서 상동재조합HR으로 복구가 된다. 반면, ICL을 포함한 DNA에서는 ICL을 지나쳐서 DNA 합성이 진행되는데, ICL을 넘어서 DNA가 합성되기 위해서는 특별한 DNA 중합효소가 요구된다. 이때, 사용되는 DNA 중합효소는 A-T/G-C와 같은 상보적인 염기쌍을 엄격하게 따지지 않고, 무작위적으로 염기를 집어넣어 합성을 진행하고, 미스매치에 의한 돌연변이를 유발할 수 있다. 이는 NHEJ와 비슷하게 세포에는 국소적으로 발생하는 돌연변이보다 DNA 복제가 이루어지지 않는 상황이 훨씬 더 치명적이기 때문이다. 이렇게 ICL과 같이 변형된 염기를 통과해서 DNA 합성이 진행되는 것을 ‘Translesion synthesis’라고 하며, 이때 사용되는 특별한 DNA 중합효소를 ‘Translesion DNA 중합효소’라고 한다. Translesion synthesis이후 남아있는 ICL은 앞에서 언급한 NER에 의해서 제거된다.
마치며
위에서 언급한 다섯 종류의 DNA 손상복구 기전들은 가장 보편적이며 대부분의 DNA 손상을 복구한다. 각 손상복구 단계별로 더 많은 단백질들과 더 구체적인 분자생물학적 메커니즘들이 존재하지만, 본 글에서는 기본적인 개념을 중심으로 기술하였다. 위에서 언급된 손상복구 메커니즘들 이외에도 더 많은 종류의 DNA 손상복구 기전들이 존재하고, 우리가 일상생활을 건강하게 누리고 우리의 유전자를 자손들에게 정상적으로 넘겨주도록 도와주고 있다. 많은 질병들이 유전자의 변형에 의해서 발생하고, 이러한 질병들이 다음 세대로 유전이 되는데, DNA 손상복구 기전들을 잘 이해함으로써 이러한 질병들을 더욱 근원적으로 치료할 방법을 제시할 수 있을 것이다.