2019년 12월 중국 우한시에서 최초 발생한 코로나바이러스감염증-19COVID-19(이하 코로나19)는 사스코로나바이러스-2SARS-CoV-2라는 신종바이러스에 의해 발생하는 바이러스성 호흡기 질환이다. 코로나19로 인해 전 세계적으로 2000만 명 이상의 감염자와 80만 명 이상의 사망자가 발생하였고 현재도 확산 중이다. 세계보건기구WHO, 미국식품의약국FDA은 물론 각국의 정부기관 및 학계, 제약산업계에서 연구에 박차를 가하고 있으나, 안타깝게도 아직까지 치료제나 백신은 나오지 않았다. 바이러스는 유전정보를 가진 ‘핵산nucleic acid’과 핵신을 둘러싼 껍질인 ‘단백질protein’로만 구성된 매우 단순한 구조를 지니지만, 바이러스를 잘 타겟팅하여 완벽히 퇴치하는 것은 현재 상황이 보여주는 것처럼 녹록하지 않다. 핵산으로서 DNA와 RNA를 모두 가지고 있는 세포에 비해, 바이러스는 보통 DNA와 RNA 둘 중 하나만을 가지고 있으며 숙주 세포를 감염시킨 뒤 폭발적으로 자기복제replication를 해낼 수 있다. 바이러스가 숙주 내에서 활동하는 생활사를 바탕으로 각 단계를 공략하여 항바이러스제를 개발하게 되는데, 이번 글에서는 이러한 항바이러스제의 개발 전략에 대해 소개하고자 한다.
바이러스의 특징 및 종류
바이러스는 증식, 유전, 적응 등의 생명현상을 나타내지만, 세포 기관이나 독립적인 효소가 없어 자체적인 물질 대사가 불가능하다. 따라서 숙주 세포의 효소를 이용하여 증식하고 물질대사를 해야 하기 때문에 생존을 위해서는 반드시 숙주를 필요로 한다. 사회적 거리두기를 통해 바이러스 감염을 방지할 수 있는 이유는 바이러스가 사람(숙주) 대 사람(또 다른 숙주)으로 바로 전파되지 못하고, 중간에 사물로 옮겨간 상태에서는 일정 기간이 지나면 사멸하기 때문이다. 진핵eukaryotic 생물의 경우에는 DNA 복제 시 돌연변이율이 낮고 돌연변이가 생길지라도 교정 Repair 기능을 가지는 데 반해, 바이러스의 경우 자기복제를 할 때 DNA 또는RNA 중합효소polymerase의 교정 기능이 없어 돌연변이 빈도가 상당히 높다. 이는 특정 약제에 대한 바이러스의 내성이 생기는 주된 기전이기도 하다.
바이러스는 숙주의 종류에 따라서 식물 바이러스, 동물 바이러스 및 세균 바이러스(파지phage)로 나뉘기도 하지만, 보통 유전자 종류에 따라 DNA 계통 바이러스 및 RNA 계통 바이러스로 분류된다. 특히, 핵산 가닥이 겹가닥double-strand, ds인지 외가닥single-strand, ss인지에 따라 dsDNA 바이러스, ssDNA 바이러스, dsRNA 바이러스, (+)ssRNA 바이러스, (−)ssRNA 바이러스, ssRNA-RT 바이러스, dsDNA-RT 바이러스로 나눌 수 있다. 이번 신종 코로나바이러스와 같은 RNA 계통 바이러스는 돌연변이 발생률이 매우 높으며, 따라서 백신 개발에 어려운 측면이 있다.
바이러스의 구조
바이러스는 유전물질인 DNA 또는 RNA와 그것을 둘러싸고 있는 단백질 껍질로 구성된 매우 간단한 구조로 되어 있다. 단백질 껍질인 캡시드capsid는 구슬 모양의 캡소머capsomere라고 하는 단백질들이 모여 이루어지며, 단백질 껍질 이외에 지질로 이루어진 외피envelope를 가지기도 한다. 특히, 이번 SARS-CoV-2를 포함한 일부 바이러스들은 막 바깥쪽 표면에 스파이크단백질spike protein이라고 하는 돌기 형태의 구조가 촘촘히 붙어 있으며, 이것들이 숙주세포와의 강한 결합을 유도하여 숙주세포 속으로 빠르게 침투하도록 지지해주는 역할을 한다. 그 밖에 바이러스 복제에 필요한 몇몇 단백질(단백분해효소protease, RNA 중합효소RNA-dependent RNA polymerase 등)을 가지고 있으며, 이들이 각 단계별 약물 타겟으로써 활용될 수 있다.
살고자 하는 바이러스와 이를 이용한 항바이러스제의 개발 전략
바이러스가 숙주 세포 안으로 들어와 살아남는 과정을 살펴보면, (1) 우선 숙주의 세포막에 존재하는 특정 단백질을 인식하고 흡착 adsorption하여 숙주세포와의 강력한 결합을 유도한다. (2) 바이러스와 숙주세포가 융합fusion을 일으켜 바이러스 껍질이 벗겨진 후uncoating 유전물질이 숙주 세포 안으로 침입하고, (3) 숙주 세포의 리보좀ribosome, 효소enzyme 등을 마치 자신의 것인 양 사용하여 유전물질을 복제하고 단백질 껍질capsid을 합성한다. (4) 바이러스의 단백질분해효소viral protease를 통해 완성된 자손 바이러스는 다시 숙주 세포막과 융합하여 출아budding 과정을 거쳐 숙주 세포 밖으로 방출된다. 항바이러스제antiviral drug는 체내에 침입한 바이러스의 작용을 약화 또는 소멸시키기 위해 사용하는 약물을 말하며, 위와 같은 바이러스의 생활사Life cycle, 즉 바이러스 복제 과정을 단계별로 막는 것이 대표적인 개발 전략이다.
세포 흡착 방해
바이러스 침투를 직접적으로 막는 첫 번째 방법은 바이러스가 숙주 세포 안으로 들어가지 못하도록 흡착을 방해하는 것이다. 대표적인 약물로는 말라리아 치료제인 클로로퀸chloroquine, 호흡기세포융합바이러스Respiratory syncytial virus (RSV)를 예방하는 항체 주사인 시나지스Synagis®(성분명: 팔리비주맙palivizumab) 등이 있다.
유전물질 복제 방해
바이러스를 막는 또 다른 방법은 숙주 세포 안으로 들어온 바이러스의 유전물질 복제를 방해하는 것이다. 요즘 코로나19의 치료제로 가능성이 점쳐지고 있는 렘데시비르 Remdesivir나 갈리데시비르 Galidesivir 등은 코로나바이러스의 RNA 중합효소에 달라붙어 복제를 막는 기전을 이용한다. 또한 유전물질 합성을 방해하는 역전사 효소Reverse transcriptase 억제제로는 헤르페스 치료제인 조비락스zovirax®(성분명: 아시클로버acyclovir), 발트렉스valtrex®(성분명: 발아시클로버valacyclovir)가 있다. 에이즈AIDS(HIV) 치료제인 칼레트라Kaletra®(성분명: 로피나비르Lopinavir/리토나비르ritonavir)는 단백질분해효소Protease를 저해하여 단백질 제작을 방해하는 역할을 한다.
바이러스 방출 저해
바이러스가 복제를 끝낸 후 증식의 마지막 단계에서 숙주세포로부터 방출egress되는 과정이 필요한데, 이러한 바이러스 방출 저해 기전을 이용한 약물이 바로 인플루엔자 치료제 타미플루tamiflu®(성분명: 오셀타미비르oseltamivir)이다. 인플루엔자 바이러스는 표면에 뉴라미니다아제Neuraminidase라는, 숙주 밖으로 방출될 때 중요한 역할을 하는 효소를 가지고 있다. 타미플루는 해당 효소를 저해하여 항바이러스 효과를 나타내게 된다. 그 밖에 파비피라비르Favipiravir 등의 약물은 복제된 RNA에 돌연변이를 일으켜 바이러스 입자 조립Assembly과 세포 밖으로의 방출을 어렵게 만드는 것으로 추정된다.
타미플루 이야기: 뉴라미니다아제 저해제와 바이러스 변이
인플루엔자Influenza 바이러스의 경우 외피에 항원성을 나타내는 두 개의 당단백질Glycoprotein, 헤마글루티닌Hemaglutinin과 뉴라미니다아제Neuraminidase를 가지고 있는데, 이들의 조합에 따라 H1N1, H2N2 등으로 아형을 분류한다. 헤마글루티닌은 숙주의 세포막에 존재하는 글리칸glycan의 시알산Sialic acid에 결합한 후, 바이러스를 세포 내로 융합시키는 데 중요한 역할을 한다. 하지만 숙주 세포 안에서 복제를 끝낸 바이러스가 세포 밖으로 방출될 때에는 시알산이 계속 세포막에 있으면 바이러스가 방출되지 못하고 다시 융합될 가능성이 있게 된다. 이때, 뉴라미니다아제가 시알산을 제거하여 바이러스의 방출을 용이하게 하며, 따라서 뉴라미니다아제를 억제하는 것이 바이러스의 증식을 막는 전략으로 이용될 수 있다.
1983년 인플루엔자 바이러스 H2N2형의 뉴라미니다아제 3차원 결정 구조가 규명되었고, 1991년 뉴라미니다아제와 시알산이 결합된 3차원 복합체 구조가 밝혀졌으며 이를 통해 시알산이 결합하는 포켓과 해당 아미노산들에 대한 정보를 알 수 있었다. 이를 기반으로 기질인 시알산과 유사한 구조를 가지면서 뉴라미니다아제에 더 강하게 결합하여 시알산과의 결합을 막는 뉴라미니다아제 저해제 디자인이 시도되었다. 이렇게 개발된 리렌자Relenza®(성분명: 자나미비르Zanamivir)는 뉴라미니다아제를 저해하는 기전의 화합물로는 최초인 “퍼스트인클래스First-in class“ 저해제라고 할 수 있으나, 경구 생체이용율oral bioavailability이 좋지 않아 빠르게 배출되기 때문에 경구투여제로는 만들지 못하였고, 분말 형태의 흡입제로 이용해야 하는 한계가 있었다.
이후 길리어드사Gilead Science는 생체이용률이 높은 저해제 개발을 위해 시알산 유도체가 아닌 뉴라미니다아제의 반응중간체transition state와 구조가 유사한 신규 스캐폴드scaffold를 이용한 약물 개발에 착수하였다 특히, 생체 밖에서는 약효를 나타내지 않다가 생체 내 대사에 의해 실제 활성이 있는 물질로 변환되는 프로드럭Prodrug으로 안정성을 높이고 경구 생체이용율을 크게 증가시키는 효과를 얻을 수 있었다. 이렇게 개발된 약물이 바로 타미플루Tamiflu(성분명: 오셀타미비르Oseltamivir)이다. 타미플루는 경구 투여가 가능한 최초의 뉴라미니다아제 저해제로서, 흡입투여만 가능한 리렌자에 비해서 환자 순응도가 좋아 높은 시장 점유율을 가질 수 있었다.
문제는 신종플루, 조류독감 등 수차례의 팬데믹 현상으로 인해 타미플루 같은 항바이러스제가 광범위하게 사용되었고, 이에 따라 타미플루 내성을 보이는 바이러스가 출현했다는 것이다. 앞서 말했듯이 바이러스는 다른 생명체에 기생하는 존재로서 숙주 및 주변 환경에 따라 생존에 유리하도록 자신을 바꾸는 능력이 탁월하다. 크기가 매우 작아서 숙주의 유전자와 잘 섞이고, 스스로 복제하는 과정에서 교정 기능이 떨어지기 때문에 바이러스의 변이는 어떻게 보면 자연스러운 현상이며 진화의 한 과정으로 설명할 수 있다. 타미플루 내성 바이러스는 대부분 뉴라미니다아제의 아미노산 하나가 변이된 돌연변이체(H275Y: 275번째 아미노산이 히스티딘histidine에서 타이로신tyrosine으로 변이를 일으킨 형태)로서 타미플루가 잘 결합하지 못하고 활성이 떨어져 내성을 갖는다. 리렌자의 경우 퍼스트인클래스의 엄청난 이점에도 불구하고 흡입제라는 불편함 때문에 타미플루에 최고 시장점유율은 내주었다. 다만 현재까지 리렌자에 저항성이 있는 바이러스는 보고된 적이 별로 없기에 오히려 타미플루 내성 환자들에게는 리렌자 처방이 권장되고 있다.
코로나19 관련 항바이러스제 기전 및 개발 동향
안타깝게도 신종 코로나바이러스의 증식을 억제하는 것으로 입증된 항바이러스제는 아직 없고, 워낙 사태가 위중하기 때문에, 앞서 말한 타미플루 이야기와 같이 완전히 새로운 약물을 찾는 치료제 개발 전략은 어려운 실정이다. 대신 개발기간을 단축시키기 위해 다른 질병 치료에 사용되는 시판 약물의 코로나19 적응증을 확인하여 치료제로 사용하는 약물재창출Drug repositioning/repurposing 전략이 주로 활용되고 있다. 약물재창출은 이미 시판된 약물이나 개발 중 상업화가 중단된 약물을 대상으로 새로운 적응증을 찾아내는 것으로, 신약 후보물질 발굴 과정이 생략될 수 있고 안전성 측면은 이미 확보되었다고 볼 수 있기 때문에 개발기간이나 비용을 크게 절감할 수 있다. 반면 기존 물질특허 기간이 만료되지 않은 경우에는 새로운 용도특허를 받는다 하더라도 물질특허권자의 허가가 있어야만 제조 및 판매가 가능하기 때문에 개발 초기단계부터 특허 정보를 파악하여 분쟁에 대비할 필요가 있다.
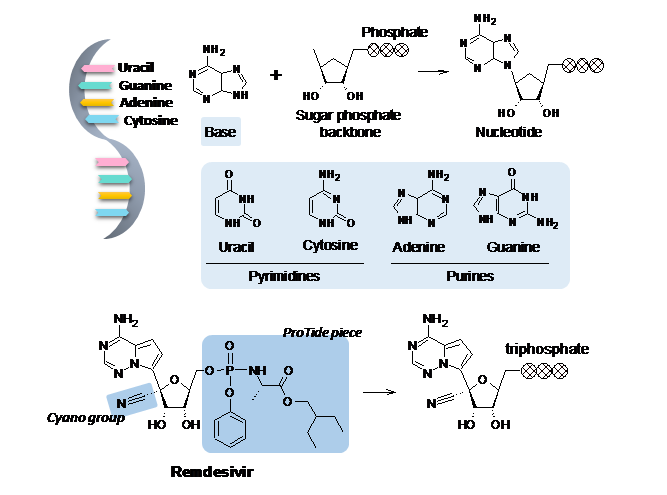
최근 RNA 복제를 막는 기전의 렘데시비르 Remdesivir가 코로나19 치료제로 긴급 승인됐으며, 현재까지로서는 가장 기대를 받고 있는 치료제 후보이다. 렘데시비르는 우리 몸속에 존재하는 아데노신 구조를 본떠 디자인되었으며, (앞서 언급된 타미플루와 같이) 체내에서 한 번 변형 후에 활성 약물이 되는 프로드럭prodrug이다. 실제 렘데시비르의 활성형은 세 개의 인산염phosphonate 그룹을 포함하고 있는 구조로서, 전체적인 모양이 DNA/RNA의 구성요소인 뉴클레오타이드nucleotide와 상당히 유사하기 때문에 바이러스의 RNA 중합효소 입장에서 헷갈리게 된다. 즉, 바이러스가 유전물질을 복제하는 과정에서 우연히 아데노신이 아닌 렘데시비르를 인식하여 복제 중인 RNA 가닥에 붙여버리게 되고, RNA의 나머지 부분이 복제되는 것을 원천적으로 차단하여 바이러스가 결국 증식하지 못하게 된다. 또한, 렘데시비르의 당sugar 부분에 치환된 CN cyano 그룹은 당고리sugar ring 모양이 뒤틀리는puckering 것을 유발해 RNA 가닥의 모양을 왜곡시키고 궁극적으로 바이러스의 복제를 방해하게 된다.
초반에 코로나 치료제로 대두되었던 클로로퀸chloroquine과 하이드록시클로로퀸hydroxychloroquine은 트럼프 대통령이 게임체인저가 될 것이라고 호언했지만 임상시험 결과 사망률이나 악화 방지의 이점을 별로 보이지 못했고, 제기되는 부작용 등에 비추어 볼 때 긴급 승인 조건에 맞는 치료 효과가 없다고 판단되어 치료제 군에서 퇴출되었다. 바이러스가 세포 내로 유입될 때 숙주 세포막과의 융합fusion을 통해 주머니 모양의 소포(엔도솜endosome)를 만들어 들어오게 되는데, 클로로퀸은 엔도솜의 산성도를 낮추는 역할을 한다. 클로로퀸 및 하이드로클로로퀸은 이러한 기전으로 말라리아 감염 치료제로 시판되었으며, 세포 침투 시 엔도솜의 산성도에 영향을 받는 몇몇 바이러스의 경우에도 항바이러스 효과가 있는 것으로 알려졌다.
하지만 코로나바이러스는 껍데기에 장착한 스파이크 단백질이 안지오텐신변화효소ACE2, Angiotensin Converting Enzyme 2에 결합하여 침투하는 전략을 주로 활용하기 때문에 엔도솜 메커니즘을 이용하는 클로로퀸은 그리 효과적이지 않았던 것으로 보인다. 숙주세포의 ACE2와 바이러스의 스파이크프로틴과의 결합 기전은 ACE2 저해효과를 갖는 고혈압 치료제를 복용하는 환자들에게 더 위험하다는 가설과 ACE2 발현이 적은 어린이들이 상대적으로 코로나에 강하다는 가설 등을 제시하는 근거가 되었지만, 아직은 좀 더 구체적이고 광범위한 연구가 필요하다고 한다. 또한 이번 신종 코로나바이러스의 경우, 숙주세포에서 빠져나가는 경로는 아직 정확하게 밝혀지지 않았지만, 어쨌든 코로나바이러스는 뉴라미니다아제neuraminidase가 없기 때문에 타미플루 역시 큰 효과가 없는 것으로 보인다.
현재 약물재창출을 통해 발굴된 몇몇 치료제 후보들은 후기 임상 단계에 와 있으며, 대부분 바이러스 감염을 억제하는 항바이러스제와 면역과잉반응으로 인한 사망 위험을 줄이는 자가면역치료제, 그리고 코로나19에 대한 항체 치료제 정도이다. 모더나사Moderna 를 비롯한 백신 개발기업들도 가장 빠른 경우 임상 2상까지 와 있다고 한다. 2020년 6월 현재 미국국립보건원NIH의 ClinicalTrials.gov에 신규 등록된 코로나19 관련 약물 중재 임상시험Drug Interventional Clinical Trials은 941건(치료제 관련 905건, 백신 관련 36건)이고, 우리나라에서 진행되고 있는 코로나19 관련 임상시험 현황은 다음과 같다.
앞서 말한 대로 바이러스는 DNA, RNA 중 하나만 가지고 있으며, 유전자 교정 gene repair기능이 없게 진화해 변이가 쉽게 일어나고 그만큼 치료제나 백신 개발이 어렵다. 사스나 메르스 모두 코로나바이러스 계통으로서 그 유사성이 밝혀졌지만, 지금 유행하는 신종 코로나바이러스는 또 다른 구조를 갖고 변이를 거듭하며 진화하고 있다. 인플루엔자 바이러스의 경우 치료제와 백신이 모두 존재하지만, 우리가 매년 인플루엔자 백신을 새로 맞더라도 독감에 걸릴 수 있는 이유 역시 바이러스의 미세한 변이 또는 진화가 계속되고 있기 때문이다. 수많은 의료진과 연구진들의 노력을 바탕으로 진정한 치료제와 백신이 개발되기까지는 절대적으로 많은 시간이 필요하다. 이러한 시간을 벌기 위해서 당장은 바이러스의 유입 및 확산을 방지하는 데 최선을 다하고 국제적인 협력과 세계 시민으로서 현명한 대처와 호응이 가장 필요한 시기이다.
참고문헌
- Strategies in the design of antiviral drugs. ED Clercq. Nature Reviews Drug Discovery 2002, 1, 13
- 약물재창출 활용 코로나19 치료제 개발을 위한 항바이러스제 특허정보집 (2020.6). 특허청 화학생명기술심사국 유기화학심사과
- Structure of the RNA-dependent RNA polymerase from COVID-19 virus. Y Gao, L Yan, Y Huang et al. Science 2020, 368, 779
- How to discover antiviral drugs quickly. JM Parks and JC Smith. The New England Journal of Medicine 2020, 382, 2261
- Therapeutic options for the 2019 novel coronavirus (2019-nCoV). G Li and ED Clercq. Nature Reviews Drug Discovery 2020, 19, 149
- World Health Organization. “Solidarity” clinical trial for COVID-19 treatments.
- Center for Disease Control and Prevention (CDC). Influenza Antiviral Drug Resistance.
- 한국임상시험포털 K-CLIC, 코로나-19(COVID-19) 임상시험 현황