2019년 마지막 달에 필자는 그리스와 네덜란드에 다녀왔습니다. 유럽 문명의 모태가 되었던 아테네의 학회에서는 성체줄기세포를 활용한 오가노이드(성체오가노이드)와 관련 유전공학기술을 소개했으며, 네덜란드의 우트레흐트 시에서는 HUBHubrecht Organoid Technology사를 방문해서 성체오가노이드를 활용한 신약개발과 환자맞춤형 치료에 대해 알아보았습니다. 같은 유럽이지만 한 곳에서는 성체오가노이드가 생소한 기술이고, 다른 한 곳에서는 미래 의학을 위한 핵심기술로 평가되는 모습이 흥미로웠습니다.
한국에는 이미 2013년부터 성체오가노이드가 소개가 되었고, 지금은 많은 대학, 연구소, 기업에서 성체오가노이드를 중점적으로 연구하고 있습니다. 비록 한국이 성체오가노이드 분야의 후발 주자이지만, 국내 역량을 집중하고 국내외 협업을 통해 성체오가노이드 상용화와 미래의학 실현에는 선발 주자가 되도록 해야 할 것입니다. 그런 의미에서 성체오가노이드가 무엇이며, 어떻게 신약개발과 환자맞춤형 치료에 도움이 될 것인지에 대해서 자세히 이야기해보도록 하겠습니다.
오가노이드 그리고 성체오가노이드란 무엇인가?
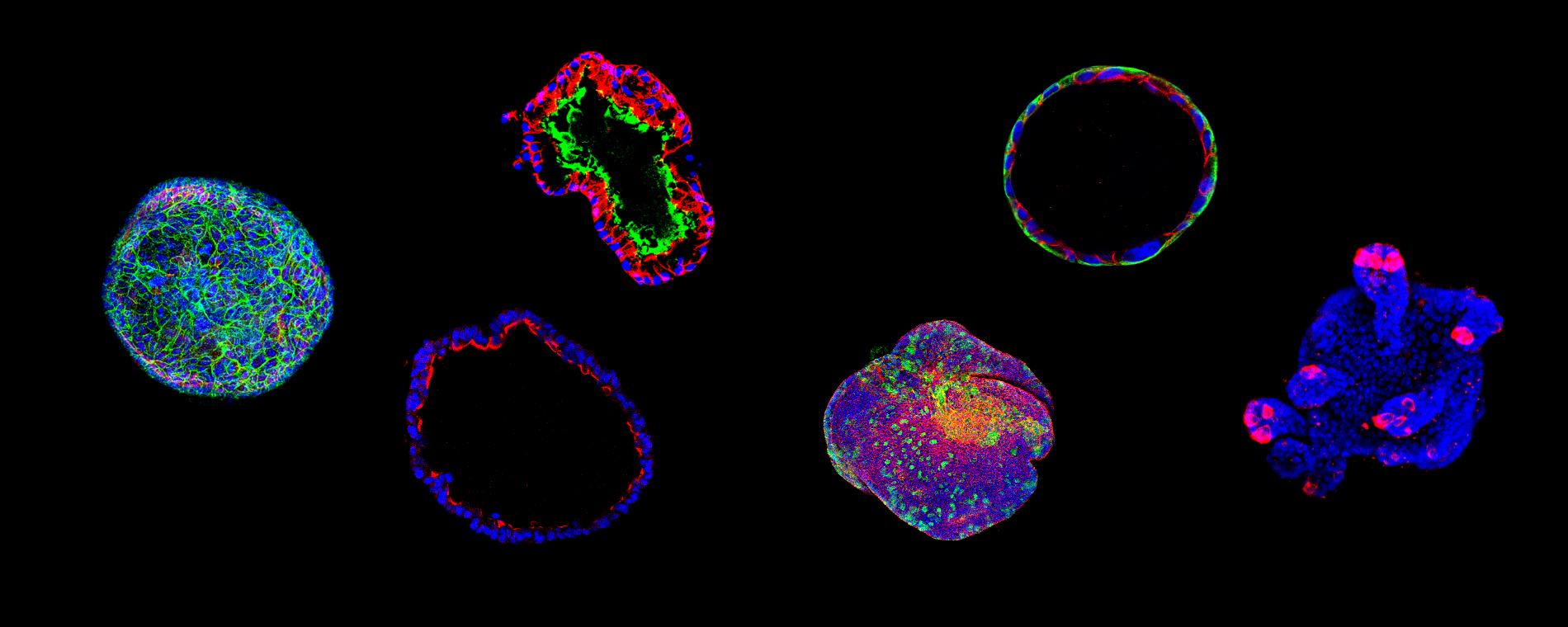
오가노이드는 3차원 형태로 자기 조직화를 하는 장기유사체를 뜻합니다. 오가노이드는 주로 두 가지 방법으로 얻을 수 있습니다. 첫 번째 방법은, 실제로 먼저 시도되었으며 세계적으로도 보편화된 방법으로, 유도만능줄기세포iPSC를 분화시키고 배 발생단계의 장기가 형성되는 조건을 모사하여 태아 단계의 오가노이드를 만들고 이를 더욱 성숙시켜서 성체의 장기와 유사한 오가노이드로 분화시키는 방법입니다.
과학적으로는 모든 발생 단계에 대한 구체적인 이해를 토대로 우리가 원하는 장기의 배 발생을 배양접시에서 구현한다는 점에서 매우 배울 점이 많은 접근 방법입니다. 장기의 발생에서 동반되는 지지세포, 혈관세포, 신경세포 등을 함께 넣어 줌으로써 복잡한 장기를 좀 더 정밀하게 모사할 수 있다는 가능성도 가지고 있습니다. 또한 이미 잘 검증된 환자 유래 유도만능 줄기세포주들을 활용할 수 있고, 실용적인 측면에서 한 개의 유도만능 줄기세포주로부터 다양한 장기를 동시에 만들어 낼 수 있다는 큰 장점을 갖고 있습니다. 반면에 짧게는 몇 주에서 길게는 수개월에 걸친 복잡한 분화과정을 거쳐야 하며, 단계가 많은 만큼 실제 장기를 얼마나 완벽하고 정확하게 구현하는지에 대한 정확한 검증이 많이 요구됩니다.
두 번째 방법은 각 장기에 존재하며 장기의 재생을 담당하는 성체줄기세포를 활용해 성체오가노이드를 만드는 방법입니다. 최초의 성체줄기세포를 활용한 성체오가노이드는 쥐의 소장에 존재하는 LGR5+ 소장 상피 줄기세포로부터 만들어졌습니다. 성체오가노이드 배양에서 가장 중요한 점은 라미닌Laminin이 풍부한 지지체를 활용했다는 것과 성체줄기세포가 필요로 하는 미세환경Microenvironment 혹은 Niche을 구현하는 성장인자의 조합을 알아낸 것입니다. 수십 가지의 지지체 단백질 중 라미닌이, 그리고 수백 가지 이상의 성장인자 중에 최적 조합으로 EGF, Noggin, R-spondin(줄여서 ENR) 세 가지 성장인자가 필요하다는 사실은 성체줄기세포 분야에서 매우 중요한 발견입니다. 이러한 발견을 바탕으로 쥐의 다른 장기와 사람의 다양한 장기에서 성체줄기세포를 3차원 입체배양하는 방법이 개발되었고, 사람의 경우 현재는 거의 모든 내장기관 및 분비기관(폐, 위, 간, 소장, 대장, 방광, 전립선, 자궁내막, 신장, 췌장, 유선)의 상피세포를 성체오가노이드 형태로 키울 수 있게 되었습니다.
성체오가노이드 기술의 가장 큰 장점은 몸 안에 항상 존재하는 성체줄기세포를 활용함으로써 별도의 복잡한 분화과정 없이 단 며칠 내에 성체조직을 성체오가노이드로 키워낼 수 있다는 것입니다. 성체오가노이드 기술을 이용하면 유전병이나 만성 질병을 가진 환자의 조직 검체를 활용하여 바로 유전병이나 만성 질병을 모델링할 수 있는 환자유래 성체오가노이드로 키울 수 있습니다. 가장 기대되는 활용처는 암 환자의 암조직 검체를 바로 배양해서 만드는 환자 유래 암오가노이드 기술입니다. 이를 이용해서 모든 암 환자의 암조직을 암오가노이드로 만들고, 실시간 환자맞춤형 치료를 하거나 신약개발을 위한 전임상 플랫폼으로 활용할 수 있습니다.
물론 단점도 존재합니다. 주로 상피세포만 키우는 기법이라는 한계점이 있는데, 이러한 단순성은 오히려 대량 배양과 대량 스크리닝에서는 장점이 되기도 합니다. 다양한 세포의 상호작용을 구현하기 어렵다는 단점도 상피세포와 지지세포 혹은 면역세포를 함께 배양함으로써 극복하고 있기도 합니다. 성체오가노이드는 다양한 활용도를 지닌 기술이지만, 여기에서는 현재 성체오가노이드 기술이 어떻게 생의약학 분야에서 변화를 이끌고 있는지 환자맞춤형 치료와 신약개발의 측면에서 소개하고자 합니다.
낭포성 섬유증과 오가노이드 기반 환자맞춤형 치료
낭포성 섬유증Cystic Fibrosis은 백인들에게 많은 유전질병으로, 염소 이온의 세포막간 이동을 조절하는 CFTR 지질단백질의 돌연변이로 인해 발생합니다. 복잡하게 들리지만 간단하게 이야기하자면, CFTR이라는 지질단백질이 망가지면서 염소 이온 분비가 저해되면, 점막의 수분이 줄어들면서 폐나 다른 장기에 감염을 통한 만성적 염증이 수반되는 질병입니다. 다행히 국내에는 환자가 극히 드물고, 백인 사회에서는 흔한 유전병으로 잘 알려져 있습니다. 낭포성 섬유증을 발생시키는 돌연변이의 종류는 매우 다양해서 CFTR 지질단백질이 아예 발현이 안 되는 경우와 기능이나 구조에 중요한 아미노산이 변형된 형태가 있습니다. 이 중 가장 흔한 돌연변이는 508번째 페닐알라닌이 사라진 DF508이며, 이외에도 다양한 희귀 돌연변이가 존재합니다.
버텍스Vertex사는 낭포성 섬유증을 치료하기 위해서 변형된 CFTR 지질단백질의 구조를 고쳐 세포막으로 더 많이 이동시키거나(Lumacaftor/Tezacaftor), 염소 이온 이동성을 높이는(Ivacaftor) 다양한 약물을 개발하였고, 약물의 병용을 통해 많은 환자들의 병세를 호전시킬 수 있었습니다. 버텍스Vertex사는 이들 약물의 판매 및 사용을 2012년에 FDA로부터 허가를 받았지만, 최근까지도 1년 치료비용이 약 3억 5천만 원(미화 3십만 달러)에 달해 많은 환자가 신약의 혜택을 보지 못하고 있는 실정입니다. 특히 약물이 반응하는 유전형을 가지고 있어도 반응성이 없는 경우가 있는데, 이를 알아보기 위해서 치료를 최소 2-3달 지속해야 하므로, 약에 대한 효능이 있는지 알아보기 위해서만 개인이 약 1억 원을 지출해야 하는 상황입니다. 그뿐만 아니라 FDA 승인을 받은 유전형의 환자 외에 다양한 희귀 돌연변이형을 지닌 환자들도 약물의 도움을 받을 가능성이 있지만, 고비용으로 인해 치료를 받을 가능성이 완전히 막힌 상황이었습니다.
네덜란드의 HUB사는 우트레흐트 의과대학과 함께 직장에서 추출한 성체오가노이드를 이용하여 CFTR 단백질의 활성을 측정하는 진단법을 개발하였고, 이를 이용하여 많은 네덜란드 낭포성 섬유증 환자들의 버텍스Vertex사 약물에 대한 반응성을 진단해주었습니다. 성체오가노이드를 이용한 진단법은 매우 간단해서, 환자가 병원에 방문하면 항문을 통해 직장 조직 검체를 채취하고, 1-2주 이내에 성체오가노이드를 생성시킨 이후에 버텍스Vertex사 약물에 대한 반응을 단 몇 시간 안에 알아내는 매우 효율적인 방법입니다. 새로 개발한 진단법은 약물 반응성을 정밀하게 측정하는 것으로 발표되었고, 반응성을 알아보는데 필요한 초기 치료 자금의 십 분의 일 수준의 비용으로 약의 도움을 받을 수 있는 환자를 발굴해 낸다고 합니다. 특히 네덜란드는 전 국민이 의료보험 혜택을 받고 있어, 긍정적인 검사 결과를 보인 환자들은 수월하게 약물을 제공받을 수 있다고 합니다.
나아가 FDA 승인 범주에 들어가지 않는 매우 희귀한 돌연변이를 가진 환자들에 대해서도 성체오가노이드를 이용한 약물 반응성 검사를 제공하고 있으며, 긍정적인 결과를 보인 경우에는 FDA 비승인 유전형인 경우에도 신약의 도움을 받을 수 있다고 합니다. 갈수록 비싸지는 신약 가격을 생각해 보았을 때, 앞으로 성체오가노이드를 기반으로 한 환자맞춤형 정밀치료의 중요도는 매우 크다고 생각합니다.
환자 유래 암오가노이드
암은 인간의 여러 질병 중에 가장 정신적, 육체적 고통이 큰 동시에 경제적 타격을 주는 질병이라고 생각합니다. 많은 신약 개발사들의 공통된 목표가 새로운 항암제를 개발하는 것이지만, 수많은 항암제의 개발에도 불구하고 암은 여전히 불치의 병으로 여겨집니다. 암 치료가 이렇게 어려운 이유를 살펴보면, 환자 유래 암오가노이드가 어떻게 암 치료의 새로운 지평을 열어줄 수 있는지 이해할 수 있습니다.
먼저 암은 매우 복잡한 질병입니다. 같은 대장암이라도 서로 다른 환자에 존재하는 대장암은 다른 종류의 유전자 및 유전체 변형을 가진 질병입니다. 심지어 한 환자 안에 존재하는 대장암 세포들 사이에도 돌연변이의 종류가 다르다는 것이 학계의 정설입니다. 현재까지도 우리는 이러한 암을 치료하기 위해서 전체 암 환자의 10%도 대변하지 못하는 암세포주를 이용하고 있습니다. 이러한 암세포주의 한계를 극복하기 위해서 유전자 조작 생쥐를 활용하는 경우도 있지만, 인간과 생쥐의 생리적인 특성이 동일하지 않으며, 이미 생쥐의 암은 실험적으로 치료가 잘 되지만 인간에게는 잘 적용하지 못하고 있는 실정입니다. 지난 십여 년 동안에는 암 환자의 조직을 면역억제 생쥐모델에서 키워서 연구하는 아바타 생쥐PDX model가 각광을 받았지만, 고비용과 저효율로 인해서 암세포주나 유전자 조작 생쥐 모델을 완전히 대체하지 못하였습니다.
반면 최근에 도입된 암오가노이드는 적절한 비용에 고효율로 환자 유래 암조직을 오가노이드화 할 수 있는 기술입니다. 현재 10여 가지 암조직에 대해서 암오가노이드를 구축하는 기술이 개발되어 소개되어 있으며, 대부분의 경우 낮게는 50% 높게는 90%의 효율로 암 환자의 조직을 오가노이드화 할 수 있는 시대가 도래했습니다. 다르게 말하자면, 서울시의 대규모 병원에서 치료를 받는 수백, 수천 명의 암 환자 조직을 암오가노이드 형태로 배양하고, 동결 저장하고, 사용 가능한 모든 약품을 활용하여 새로운 항암제나 새로운 치료법을 개발할 수 있는 플랫폼이 만들어졌다고 할 수 있습니다.
‘오가노이드는 실험실의 환자다‘라는 문구를 가지고 많은 유명 대학병원과 연구소에서 오가노이드를 활용한 암 환자조직 바이오뱅킹을 진행하고 있습니다. 전에는 이미 고정되어 죽어버린 암조직을 조직학과 유전학으로만 연구했는데, 이제는 직접 환자조직을 오가노이드화하여 실험실에서 언제든지 암오가노이드를 키우고 치료하면서 새로운 항암제를 연구 할 수 있는 길이 열린 것입니다. 최근 HUB이 학회에서 정상조직 유래 오가노이드는 죽이지 않으면서, 암오가노이드의 성장만을 특이적으로 저해하는 신규항암물질을 수백 명 분의 암오가노이드에서 테스트한 결과를 발표하였는데, 전임상을 거쳐 임상에 들어가는 전체 기간이 2년 남짓 걸렸다고 합니다. 더불어 다양한 항암제의 전임상 테스트를 지원하는 크라운바이오CrownBio사는 기존에 보유하고 있는 암세포주, 생쥐 모델, 아바타 생쥐에 더해 암오가노이드 모델을 추가하기로 결정하면서, HUB사로부터 해당 분야에 대한 독점 라이선스 계약을 체결하였습니다. 전임상 테스트 분야를 선도하는 기업의 전격적인 움직임이라 그 의미가 매우 크다고 생각합니다.
마지막으로 환자유래 암오가노이드 기술은 환자맞춤형 정밀의료의 새로운 플랫폼이 되고 있습니다. 2018년부터 여러 주요 저널에 발표된 암오가노이드 연구에 따르면 암오가노이드를 기반으로 항암제 혹은 방사선치료 효과를 진단한 결과가 실제 환자가 보여주는 반응성과 매우 높은 일치도를 보여준다고 합니다. 환자 유래 암오가노이드는 우선 환자에게 효과가 없는 항암치료를 선별하는 데 도움을 준다고 합니다. 2-3개월 동안 고통받으면서 고비용의 항암치료를 받기 전에, 자신에게 치료 효과가 있을지 없을지를 암오가노이드 기반 진단법이 알려줄 수 있다는 내용입니다. 다음으로 환자유래 암오가노이드는 사용 가능한 항암제 중에 가장 최적의 약물을 선별하는 데에도 도움을 준다고 합니다. 앞으로는 환자 유래 암오가노이드를 통해, 병원에서 사용 가능한 모든 항암제 중에 각 개인에게 최적화된 항암제를 실시간으로 선별해 주는 맞춤형 서비스가 가능해질 수도 있을 것으로 기대됩니다.