멀티 타임스케일Multi-timescale 생명 시스템
생명 시스템은 다양한 속도로 변화한다. 분자의 모양은 나노초 단위로 변화하고 단백질은 초, 분 단위로 상호작용하며 세포는 하루 단위로 분열하고 우리의 몸무게와 키는 그것보다 훨씬 더 느린 속도로 변화한다. 이렇게 짧은 타임스케일부터 긴 타임스케일의 변화로 구성된 시스템을 멀티 타임스케일 시스템이라고 한다.
이러한 멀티 타임스케일 시스템은 보통 이해하기가 쉽지 않다. 예를 들어, 어떤 특정한 호르몬의 생성 패턴이 우리 몸무게의 변화에 영향을 주는지 혹은 몸무게의 변화가 호르몬 생성 패턴에 영향을 주는지 연구한다고 하자. 호르몬 생성량은 대략 분 단위로 변화하지만, 몸무게는 훨씬 긴 타임스케일에서 변화한다. 호르몬 생성 패턴을 보고 싶으면 매분 호르몬의 양을 측정하며 한 시간 정도 살펴보면 될 것이다. 반면 몸무게가 어떻게 변화하는지를 보려면 매주 측정하며 1년 정도는 측정해야 할 것이다. 그런데 호르몬 생성패턴과 몸무게의 변화를 동시에 관찰하려면 1분마다 1년을 관찰해야 하는 불편함이 생긴다.
이러한 멀티 타임스케일 시스템 분석을 용이하게 하는 방법 중 하나는 짧은 타임스케일 혹은 긴 타임스케일에 국한해서 보는 것이다. 예를 들어, 분 단위의 짧은 타임스케일로 국한하면 호르몬은 변화하지만, 그동안 몸무게는 변화하지 않는다고 가정해도 무방하다. 따라서 호르몬의 변화만 측정하면 충분하고 몸무게의 변화를 분 단위로 측정할 필요는 없다.
반대로 주 단위의 긴 타임스케일에서는 어떨까? 일단 몸무게의 변화는 매주 측정해야 할 것이다. 그럼 호르몬 변화는 어떻게 해야 할까? 매분 변화하는 호르몬을 변화하지 않는다고 할 수도 없고, 호르몬을 매분마다 1년 동안 측정할 수도 없는 노릇이다. 이를 위해서는 특이 섭동Singular perturbation 이론을 이용해야 한다.
특이 섭동Singular perturbation 이론
이 상황을 이해하기 위해서 천천히 변화하는 변수 x와 빠르게 변화하는 변수 y가 섞여 있는 간단한 미분방정식을 살펴보자.
\(\frac { dx }{ dt } =-\varepsilon x,\\ \frac { dy }{ dt } =x-y.\)
ε이 작아질수록 x가 y에 비해서 더 천천히 변화하는데 극단적으로 ε→0인 경우를 생각해보자.
\(\frac { dx }{ dt } =0,\\ \frac { dy }{ dt } =x-y.\)
x는 변화하지 않고 y의 변화만 일어나는데 ε이 충분히 작으면 x는 변하지 않는 것으로 가정하고 y의 변화만 보면 되는 것을 의미한다. 짧은 시간 동안 몸무게는 변하지 않는 것으로 가정하고 호르몬만 어떻게 변하는지 보면 충분한 것처럼 말이다.
그런데 시간이 충분히 지나면 궁극적으로 x도 변화할 텐데, 이를 보려면 현재의 짧은 타임스케일(t)를 긴 타임스케일(τ=εt)로 변환 해주어야 한다. 긴 타임스케일에서 단위 시간 t=1은 짧은 타임스케일에서는 엄청나게 큰 값 t =1/ε이 된다. 1년이 31,556,926초인 것처럼. τ=εt를 원래의 미분방정식에 대입하면 아래와 같이 긴 타임스케일에서 변화를 보기 적합한 미분방정식을 얻을 수 있다.
\(\frac { dx }{ dt } =-x,\\ \varepsilon \frac { dy }{ dt } =x-y.\)
이제 x의 미분방정식에는 더 이상 ε이 없어서 ε이 0에 가까워져도 x는 여전히 변화한다. 반면 y의 미분방정식의 좌변에 ε이 위치하여 ε이 0으로 가까이 가면 미분항이 사라지고 y=x라는 관계만 남는다. 이게 어떤 의미인지 ε이 0이 아닌 원래의 미분 방정식을 풀어서 그 해를 페이즈 평면phase plane에서 살펴보자.
x, y의 초기값이 무엇이든지 상관없이 빠르게 수직으로 움직여서 y=x 상태에 도달한다. 이는 짧은 스케일에서는 x값은 거의 변화하지 않는 상태에서 y만 빠르게 움직이는 것을 뜻한다. 그런데 왜 y=x로 수렴을 하는 것일까? y의 미분방정식에서 ε를 우변으로 넘기면 \(\frac { dy }{ dt } =\frac { 1 }{ \varepsilon } (x-y)\)이 되어 y가 빠르게 움직이는 것을 알 수 있다. 그런데 y가 x에 충분히 가까이 가서 \((x-y)\sim \varepsilon \)이 되면 ε은 상쇄되어 y는 x와 같은 속도로 움직이게 된다. 즉, y는 재빠르게 변화해서 y=x 근처에 도달한 후 y는 x와 함께 y=x를 따라 천천히 움직여 x=y=0 평형상태에 도달한다. 원래 이 시스템은 2차원 공간에서 움직이지만 y는 순식간에 y=x상태로 도달하기에 긴 타임스케일에서는 y=x라는 1차원 공간을 따라서 움직인다고 봐도 무방하다.
그래서 y=x를 슬로우 매니폴드slow-manifold라고 부르고, 이는 \(\frac { dy }{ dt } =0\)식으로부터 구할 수 있기 때문에 y의 준평형상태quasi-steady state라고도 부른다. y가 재빠르게 어떤 상태로 도달할지 준평형 상태만 계산할 수 있으면 y의 미분방정식은 풀 필요가 없다. x가 어떻게 변화하는지만 추적하면 y의 상태는 준평형상태식(y=x)을 이용해서 유도할 수 있으니 말이다.
[그림1]에서 볼 수 있듯이 원래 미분방정식은 느린 변수 하나와 빠른 변수 하나로 구성되어 그 해는 2차원 공간에서 움직이지만 긴 타임스케일 혹은 짧은 타임스케일에서 각각 바라보면 1차원 공간에서 움직인다. 즉, 짧은 타임스케일에서 x는 고정되어 있고 y만 변화하는 수직선을 따라서 변화하고, 긴 타임스케일에서는 y=x 슬로우 매니폴드를 따라서 변화한다. 하나의 타임스케일에서 바라봄으로써 복잡한 시스템을 단순화할 수 있는 것이다.
미카엘리스 멘텐Michaelis-Menten식
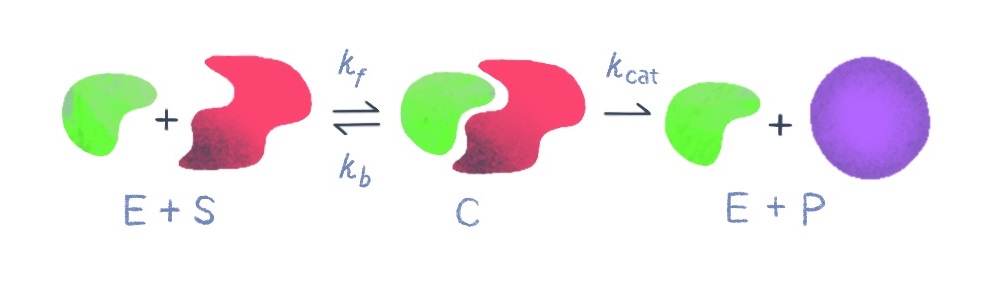
우리 몸속에서 발생하는 생화학 반응에서 가장 중요한 것 중 하나는 효소 반응이다. 몸속으로 흡수된 음식물 분자를 우리 몸에 필요한 분자로, 음주 후 몸속의 알코올을 몸 밖으로 배출할 수 있는 형태의 분자로 변형하는 것 모두 효소 반응의 결과이다. 가장 기본적인 효소 반응은 아래와 같이 하나의 효소(E)와 하나의 기질(S)로 구성되어 있다.
기질(S)이 효소(E)와 만나서 기질 복합체(C)를 만들고 효소는 기질을 다른 형태의 분자인 생성물(P)로 만들어낸다. 이 화학 반응을 미분 방정식으로 나타내면 아래와 같다.
\(\frac { dS }{ dt } =-{ k }_{ f }ES+{ k }_{ b }c\\ \frac { dE }{ dt } =-{ k }_{ f }ES+{ k }_{ b }c+{ k }_{ cat }c\\ \frac { dC }{ dt } ={ k }_{ f }ES-{ k }_{ b }c-{ k }_{ cat }c\\ \frac { dP }{ dt } ={ k }_{ cat }c\)
우선 \(\frac { dE }{ dt } +\frac { dC }{ dt } =0\)이므로 E와 C의 합은 항상 일정한데 이를 총 효소의 양 ET라고 하자. 이 불변량을 이용하면 E=ET-C이므로 변수 E를 제거할 수 있다. 나아가 보통 C는 S와 P에 비해서 훨씬 빠르게 변화한다. 즉, 효소 반응은 상대적으로 빨리 변화하는 C와 천천히 변화하는 S, P로 구성된 멀티 타임스케일 시스템이다. C가 변화하는 짧은 타임스케일에 관심 있다면 S와 P는 변화하지 않을 테니 초기값으로 고정하고 C의 미분방정식만 풀면 된다. 하지만 보통 우리가 관심있는 것은 생성물 P가 만들어지는 상대적으로 긴 타임스케일 변화이다. 이 경우 C는 준평형상태에 순식간에 도달하게 되는데, \(\frac { dC }{ dt } =0\)을 풀어 아래와 같이 준평형상태를 구할 수 있다.
\(C(S)=\frac { { k }_{ cat }{ E }_{ T }S }{ { S+K }_{ M } } \)
1913년 이 식을 깊이 있게 연구한 미카엘리스Michaelis와 멘텐Menten의 이름을 따라 이 식은 미카엘리스-멘텐Michaelis-Menten식이라고 불리며 \({ K }_{ M }=\frac { { k }_{ b }+k_{ cat } }{ { k }_{ f } }\)은 미카엘리스-멘텐Michaelis-Menten 상수라고 불린다.[1] 이 식을 통해서 우리는 S가 어떤 상태에 있는지만 알면 C의 상태는 미분 방정식을 풀 필요 없이 미카엘리스-멘텐식을 이용해서 구할 수 있다. 따라서 원래의 미분 방정식에서 C 대신 미카엘리스-멘텐식을 대입하면 아래와 같이 단순화된 미분방정식을 얻을 수 있다.
\(\frac { dS }{ dt } =-\frac { { k }_{ cat }E_{ T }S }{ { S+K }_{ M } } \\ \frac { dP }{ dt } =\frac { { k }_{ cat }E_{ T }S }{ { S+K }_{ M } } \)
이제 S와 P의 합도 불변하기에 이를 ST라고 하자. 이 불변량을 이용하면 S=ST-P이므로 변수 S를 제거하여 아래와 같이 더 단순화된 미분방정식을 구할 수 있다.[2]
\(\frac { dP }{ dt } =\frac { { k }_{ cat }E_{ T }(S_{ T }-P) }{ { S_{ T }-P+K }_{ M } } \)
[그림3]에서 보듯 원래의 복잡한 미분방정식Full과 단순화된 미분방정식Reduced을 풀면 거의 동일한 해를 가짐을 알 수 있다. 물론 초기에 C가 준평형 상태에 도달할 때까지 아주 짧은 시간 동안 조금의 차이는 있으나 긴 타임스케일에서는 보이지 않는다.
이렇게 4차원 멀티 타임스케일 시스템을 1차원 싱글 타임스케일 시스템으로 단순화하면 다음과 같은 장점들이 있다.
1. 해석: 1차원 비선형 다이내믹스를 해석하기가 훨씬 쉽다.
2. 계산: 계산 속도가 훨씬 빨라진다. 예를 들어 C가 변화하는 속도가 P에 비해서 1,000배 빠르다면 P가 한번 변화할 때 C는 1,000번 변화하고 따라서 1,000배 많은 계산이 필요하다. 따라서 C의 미분방정식을 제거한 P로만 구성된 단순화된 미분방정식을 풀면 이런 많은 계산을 하지 않아도 된다.
3. 추정: 반응이 얼마나 빨리 변화하는지 나타내는 kf, kb, kcat 값들을 직접 측정하는 것은 불가능에 가깝기 때문에 보통 생성물(P)이 시간이 지남에 따라 어떻게 변화하는지 실험을 통해서 측정하고 이 데이터와 미분방정식이 가장 유사한 해를 갖도록 하는 kf, kb, kcat 값들이 언제인지를 찾아서 역으로 이 값들을 추정한다.[2] 그런데 이러한 추정은 실험데이터와 가장 유사한 해를 갖도록 하는 kf, kb, kcat 값이 한 쌍만 존재할 때 가능하다. 과연 그럴까? 원래 미분방정식은 세 개의 매개 변수 kf, kb, kcat을 가지고 있지만 단순화된 미분방정식은kcat, KM 두개의 매개변수를 가지고 있다. 따라서 (kb +kcat)/kf=KM을 만족하는 무한한 쌍의kf, kb, kcat값들이 한 쌍의 kcat, KM값과 대응된다. 따라서 이러한 무한한 쌍의 kf, kb, kcat값을 원래의 미분방정식에 대입하더라도 그 해는 대응되는 한 쌍의 kcat, KM 을 대입한 단순화된 미분방정식의 해와 유사할 것이다. 이는 주어진 데이터와 유사한 해를 갖도록 하는 kf, kb, kcat가 무한히 존재함을 의미하고 따라서 세 개의 값은 추정할 수 없다. 이처럼 긴 타임스케일 데이터로부터 멀티 타임스케일 미분방정식의 모든 정보를 알아내는 것은 불가능하다. 따라서 긴 타임스케일의 변화만 묘사하는 단순화된 미분방정식을 이용하여 두 개의 매개 변수 kcat과 KM을 추정하는 방식이 사용되어 왔고 이 두 가지는 아래와 같이 다양한 효소의 기능을 묘사하는데 널리 사용되고 있다.
이러한 단순화된 모델의 이점 덕분에 미카엘리스-멘텐식은 생화학 분야에서 가장 널리 알려진 식이 되었으며 지난 100여 년 간 220,000여 편의 논문(Google scholar 기준)에 사용되어 왔다. 하지만 미카엘리스-멘텐식이 항상 정확한 것은 아닌데 이 식을 유도하는 수학을 제대로 이해하지 못해 안타깝게도 많은 논문에서 잘못 사용되어 왔다. 다음 글에서는 이러한 문제점과 이를 간단한 아이디어로 해결할 수 있는 방법에 대해서 이야기하려고 한다.
참고문헌
- Michaelis, L. & Menten, M. L. Die kinetik der invertinwirkung. Biochem. z 49, 352 (1913)
- Choi, B., Rempala, G. A., & Kim, J. K. . Beyond the Michaelis-Menten equation: Accurate and efficient estimation of enzyme kinetic parameters. Scientific reports, 7(1), 17018. (2017)